
Livre Blanc Acouphènes

EQUISYL - FORMULE INNOVANTE VERTIGES ET...

THALAMYL - Traitement Naturel Acouphènes &...

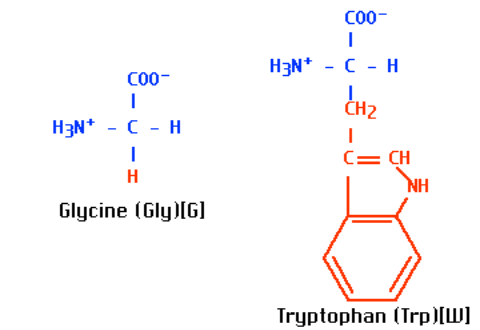
La mélatonine est synthétisée dans les pinéalocytes à partir de la sérotonine. La sérotonine a pour précurseur le tryptophane dont les réserves (foie, plaquettes, tube digestif) sont très faibles .
L’essentiel de la synthèse se produit pendant la phase d’obscurité avec une augmentation majeure ( 7 à 150 x, selon les espèces) de l’activité de la sérotonine-N-acetyltransférase (arylalkylamine-N-acetyltransférase) ou AA-NAT.
L’AA-NAT est l’enzyme limitante de la production de mélatonine, mais la disponibilité de la sérotonine joue aussi un rôle.
Le rythme de production est endogène et soumis à une régulation photonique. Il est généré par les noyaux suprachiasmatiques de l’hypothalamus, véritable horloge biologique interne centrale du cerveau,
dont la stimulation lumineuse se fait par voie rétino-hypothalamique. A partir des noyaux suprachiasmatiques, les messages sont transmis via les cornes latérales de la moëlle épinière aux neurones des ganglions cervicaux.
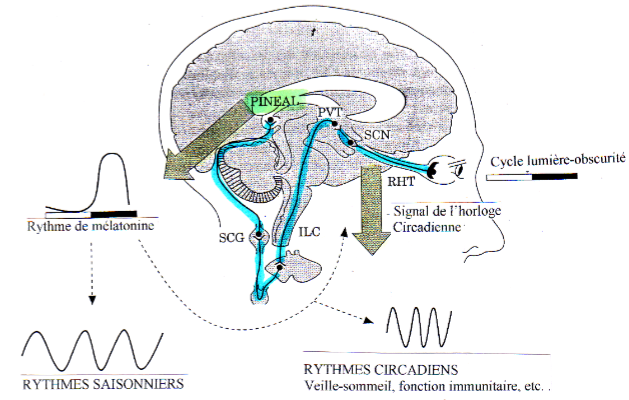

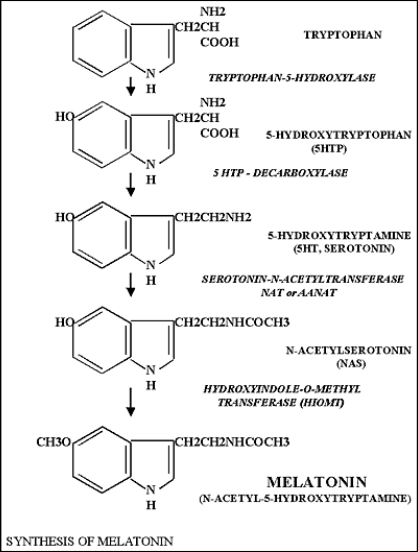
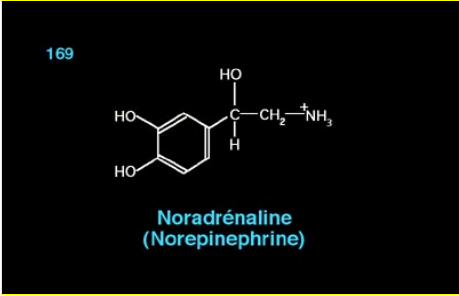
La noradrénaline libérée par les terminaisons axonales sur les pinéalocytes agit, par l’intermédiaire de l’AMPc, sur le degré d’activité de la 5-HIOMT (5hydroxy-indol- O methyltransférase) et la AA-NAT, enzymes des pinéalocytes permettant la synthèse de la Mélatonine à partir de la sérotonine circulante.
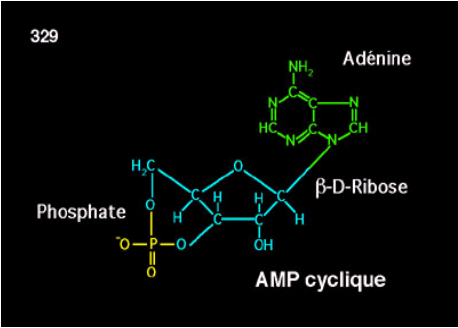
L’étude de la distribution du mRNA de l’AA-NAT montre que cette enzyme est exprimée dans la pinéale, la rétine et, à un moindre degré dans d’autres zone du cerveau, le système pituitaire et les gonades; mais à part la pinéale, ces structures contribuent très peu à la mélatonine circulante. Il semble aussi que la mélatonine puisse être synthétisée dans le tractus gastro-intestinal et puisse intervenir sur la fonction digestive.
Le rythme de la sécrétion de la mélatonine est généré par un feedback négatif en boucle fermée de l’expression des gènes à fonction d’horloge du SNC.
Le SCN gère le rythme de la mélatonine par voie neuronale. Le mRNA de la NAT et de Per oscillent dans la pinéale, bien qu’un contrôle post-transcriptionnel soit évident chez certaines espèces.
La mélatonine agit sur l’activité du SCN par un ou plusieurs récepteurs. La mélatonine transporte l’information photopériodique en influant sur le mode d’expression de Per dans le pars tuberalis pour le contrôle des variations saisonnières de la prolactine. Les sites cibles de la mélatonine de l’hypothalamus agissant sur les variations saisonnières des hormones de reproduction ne sont pas complètement déterminés.
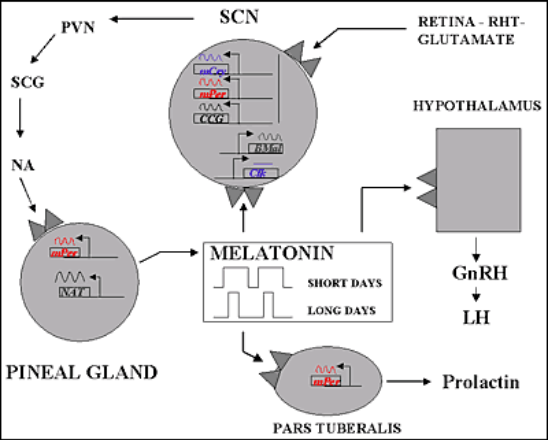
RHT=tractus rétino-hypothalammique, NA=noradrénaline, SCN=noyau suprachiasmatique, PVN=noyau paraventriculaire, SCG=ganglion cervical supérieur, Clock & Bmal=éléments stimulants de la sécrétion, Per & Cry= éléments négatifs, CCG=gènes contrôlant l’horloge.
La mélatonine est synthétisée et secrétée pendant la nuit chez virtuellement toutes les espèces selon un rythme endogène. Les rythmes circadiens sont entraînés (synchronisés) sur 24 heures en premier lieu par les cycles lumière/obscurité.
Les facteurs (Zeitgebers=donneurs de temps) autres que les cycles jour/nuit impliqués dans l’entraînement sont les contraintes comportementales telles que activité/repos, la répétition des Impératifs sociaux et nutritionnels (heures de travail et de repas), les variations de température, la notion de l’heure, certaines substances, probablement les champs magnétiques et la mélatonine elle-même.
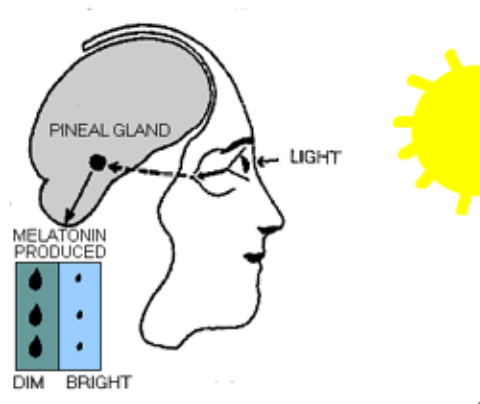
Dans la plupart des espèces, la sécrétion de mélatonine est nocturne et en relation avec la longueur de la nuit: plus celle-ci est longue, plus la durée de sécrétion est longue. Chez l’homme, 2500 lux de lumière plein spectre sont nécessaires pour supprimer complètement la sécrétion nocturne de mélatonine (la lumière domestique est environ de 100-500 lux). Des intensités inférieures peuvent toutefois supprimer partiellement la sécrétion et la décaler.
Chez l’homme et les rongeurs, la mélatonine est métabolisée en majorité dans le foie en 6-sulfatoxymélatonine (aMT6s) par hydroxylation et conjugaison phosphate.
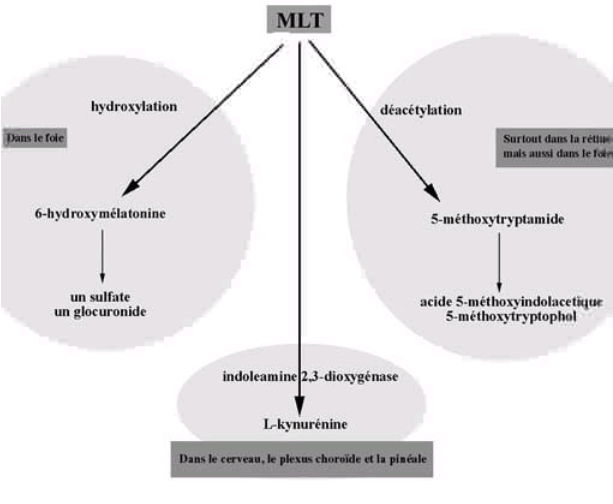
La mélatonine exogène, administrée par voie orale ou intraveineuse a une demi-vie métabolique courte (20-60 minutes selon les espèces) avec un premier passage hépatique important selon un processus biphasique.
La concentration maximum observée dans le plasma chez l’homme adulte de + de 18 ans Est de l’ordre de 60-70 pg/ml (test radio-immunologique Hautement spécifique). Les Concentrations dans la salive sont d’environ le tiers de celles du plasma, avec des concentrations minimales dans Les deux fluides inférieures à 5 pg/ml. Le pic de concentration Maximum (acrophase) se situe Normalement entre 0200 et 0400 heures.
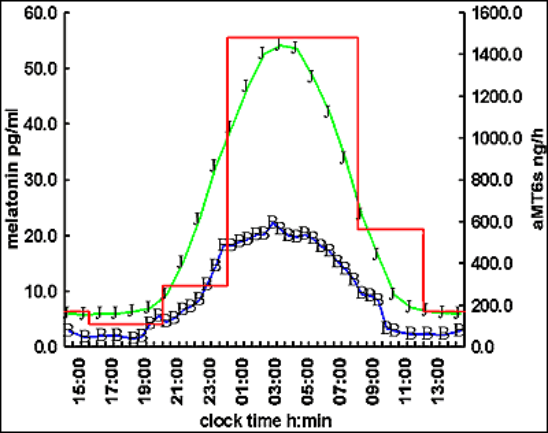
Concentration moyenne de mélatonine chez l’homme dans le plasma (N=133) la salive (N=28) et de aMMT6s dans l’urine (N=88). Evaluation par radioimmunoassay
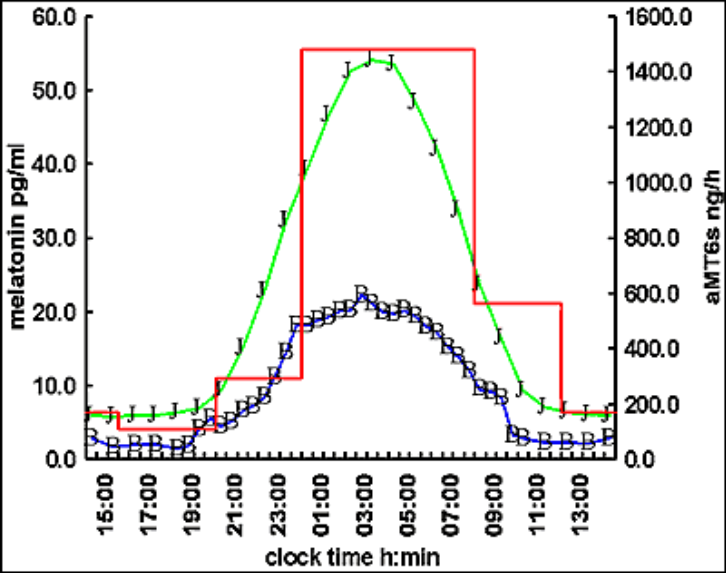
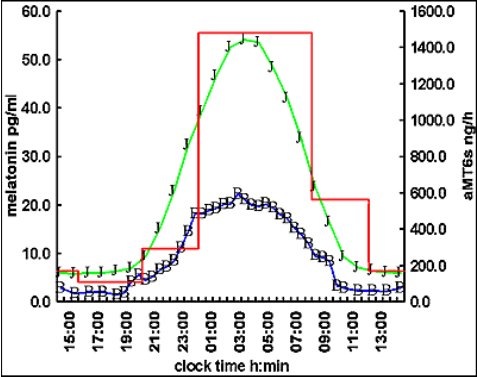
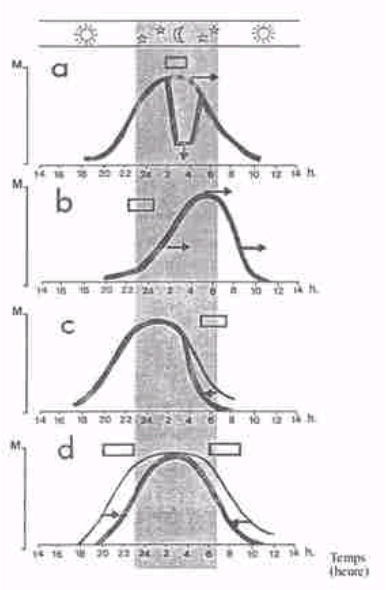
Chez l’homme adulte en zone tempérée, le début (« onset ») de la sécrétion se situe vers 2100-2200 heures, et la chute (« offset ») vers 0700-0900 heures du matin, entraînant le réveil. La baisse de luminosité entraîne le onset et la lumière le offset de sécrétion.
L’apparition et le pic de l’aMT6s dans l’urine sont décalés de 1 à 2 heures et la chute matinale de 3 à 4 heures. Il existe une très forte corrélation entre le profil et l’amplitude de la mélatonine plasmatique et de l’aMT6s urinaire, celle-ci étant un excellent moyen de mesure ambulatoire de la phase circadienne. La caractéristique la plus remarquable du rythme de sécrétion normale chez l’homme est sa reproductibilité jour après jour.
Le pic de mélatonine est étroitement associé avec le nadir de la température centrale de l’organisme, le maximum de la fatigue, la vigilance et les performances les plus basses. Un certain nombre d’observations confirment ces relations causales. La lumière intense la nuit, par exemple, supprime la mélatonine plasmatique, mais augmente en même temps la température corporelle, la vigilance, les performances et diminue parallèlement la somnolence.
L’augmentation de la température corporelle pendant le cycle menstruel va de pair avec une diminution du taux de mélatonine.
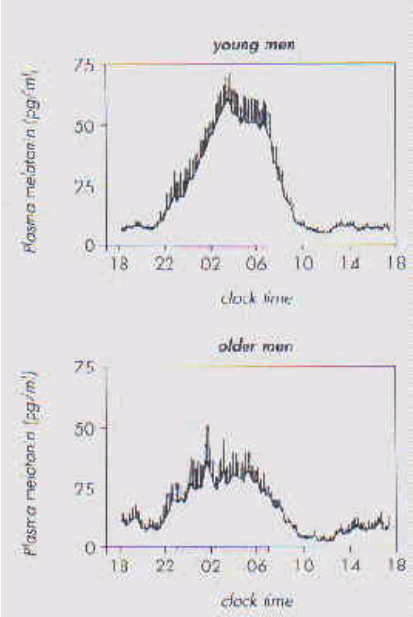
Immédiatement après la naissance, très peu de mélatonine ou d’aMT6s sont détectables dans les fluides corporels. Un rythme de mélatonine conséquent apparaît à environ 6-8 semaines. La concentration plasmatique augmente ensuite très rapidement et atteint un pic maximum définitif à l’âge de 3-5 ans. On observe ensuite une diminution constante atteignant les concentrations moyennes adultes vers 10 ans, avec une diminution surtout avant la puberté. Les valeurs restent pratiquement inchangées jusqu’à l’âge de 30-40 ans, puis l’amplitude diminue jusqu’aux taux observés chez le 3ème âge.
Il est clair que le rôle de la mélatonine est d’apporter au cerveau l’information sur les rythmes circadiens. Elle agit sur la température interne de l’organisme, le cycle du cortisol, l’alternance veille-sommeil, l’activité motrice, la vigilance, l’humeur et les activités cognitives. Elle agit sur les hormones sexuelles et les neuromédiateurs. Elle possède également des activités non chronobiologiques notamment sur le système immunitaire et des propriétés antiradicalaires puissantes.
MELATONINE, SOMMEIL & RYTHMES BIOLOGIQUES
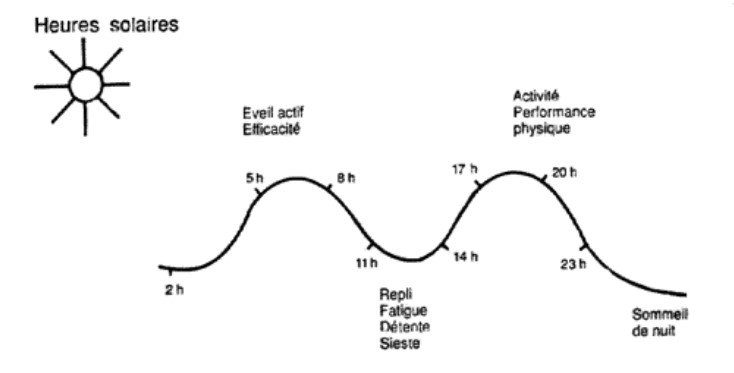
Les rythmes circadiens de vigilance réalisent un véritable tracé sinusoïdal repérable à la même heure ou presque chez tous les humains, sous toutes latitudes et corrélé à l’heure solaire. Cette vigilance est précédée directement par une autre courbe parallèle qui est celle de notre température corporelle: lorsque la température s’élève, l’organisme se prépare à une phase active, éveillée, efficace. Lorsqu’elle baisse, la vigilance ne tarde pas à diminuer. Comme indiqué précédemment, le rythme circadien de la mélatonine est complètement calqué sur celui de la température corporelle.
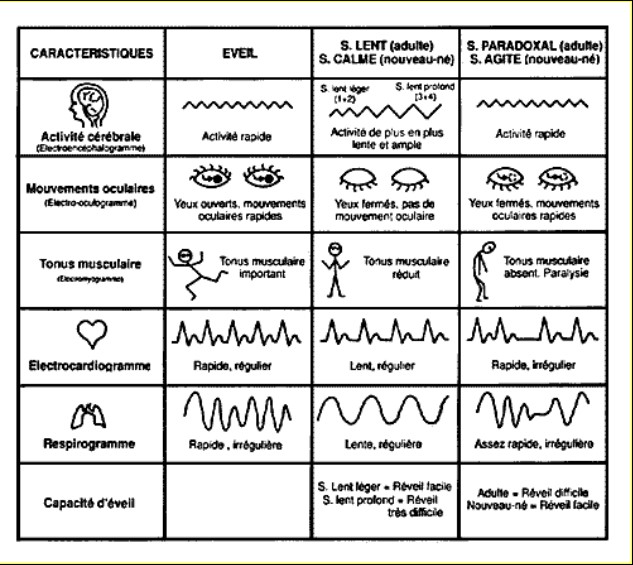
On distingue 3 états de vigilance, totalement différents les uns des autres, aussi biendans le comportement extérieur, visible, que dans leur traduction polygraphique ( EEG, EOG, EMG, ECG et respiration): l’éveil, le sommeil lent et le sommeil paradoxal.
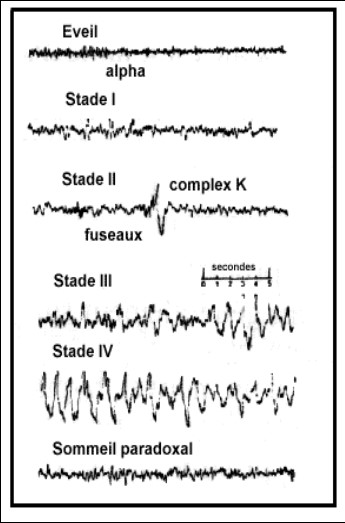
La privation de sommeil ne supprime pas le rythme de mélatonine et la lumière de faible intensité n’affecte pas la sécrétion. Dans les conditions expérimentales contrôlées, il est clair que l’augmentation de la sécrétion de mélatonine le soir correspond de près avec l’ouverture des « portes du sommeil ». On observe des relations entre la phase circadienne de mélatonine et l’apparition des fuseaux du sommeil ainsi que d’autres caractéristiques de l’EEG.
La 1ère référence historique concernant l’effet de la mélatonine sur le sommeil est due à Aaron Lerner qui a isolé la substance pour la première fois il y a 40 ans, en avala 100mg, et décrivit un accès de somnolence après ingestion. Ensuite, un grand nombre de publications, portant sur l’utilisation de doses beaucoup plus faibles (0,3-10 mg), ont décrit une avance du sommeil après administration le soir, une somnolence transitoire à différents moments de la journée 2-4 heures après la prise, une augmentation de la propension au sommeil en fonction du temps, des effets de réveil de l’ EEG, un allongement de l’épisode de REM après administration en début de soirée, une augmentation des fréquences rapides d’EEG après sommeil et des effets généralement bénéfiques (diminution du temps de réveil et augmentation globale de la durée du sommeil).
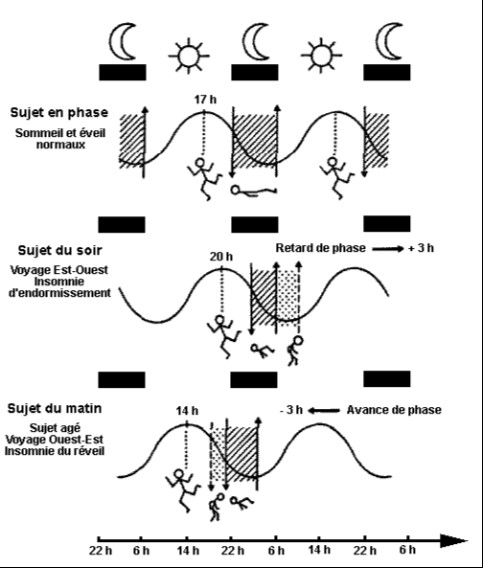
On distingue 2 grands types d’altérations de rythme circadien: les altérations de phase par retard ou avance de phase, ou des périodicité circadiennes anormales.
Les avances de phase correspondent à des horaires anormalement précoces d’endormissement. On les observe chez certains sujet dépressifs et les personnes âgées.
Les retards de phase simulent une insomnie d’endormissement , avec difficulté de réveil le matin. La courbe de température de ces sujets semble retardée.
Avances et retards de phase s’observent également lors des voyages transméridiens selon la direction (jet lag).
Les actions de la mélatonine sont multiples via un grand nombre de récepteurs dont plus de 200 ont été identifiés dans l’organisme humain. 130 d’entre eux ont été découverts dans le SNC. D’autres ont été mis en évidence dans d’autres régions du cerveau, des cellules du système immunitaire, les gonades, les reins, le système cardiovasculaire et la peau (mélanocytes). Les récepteurs à mélatonine ont maintenant été clonés,et 3 sous-types ont été nommés MT1,MT2 et MT3.
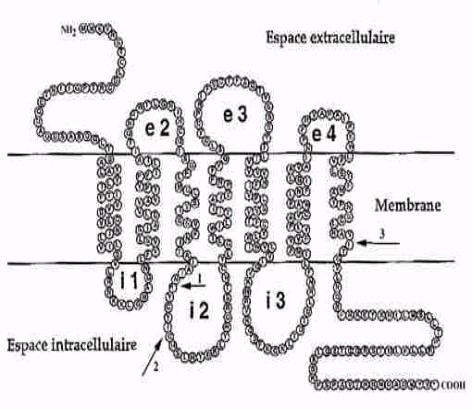
Les données actuelles suggèrent que le récepteur MT1 est le médiateur des effets circadiens et de la suppression aiguë de l’activité électrique du SNC alors que le récepteur MT2 serait impliqué dans les décalages de phase. Plusieurs autres réponses physiologiques ont été attribuées aux récepteurs MT1 et MT2, comme la potentialisation de la vasoconstriction adrénergique modulée par la mélatonine et la modulation de la libération de la dopamine dans la rétine. Le récepteur MT3 reste controversé.
Conclusion : Les etudes réalisées à ce jour indiquent qu’un très grand nombre de systèmes peuvent être influencés par la mélatonine ou provoquer des modifications des taux circulants de mélatonine. L’ importance de ces modifications n’est pas encore complètement établie et doit être encore étudiée avant de faire de la mélatonine une drogue « miracle ». Il est nécessaire que les « mélatonines » exogènes soient des extraits chimiquement purs, et soient testés comme tels, alors que les controverses sur les effets thérapeutiques potentiels de la MELATONINE viennent probablement du fait que les produits testés sont loin de l’être. Par ailleurs, le rôle de la glande pinéale dans la physiologie quotidienne de l’individu normal reste à être complètement élucidé.
Il est donc très fortement conseillé de privilégier les précurseurs naturels de mélatonine, tel le L-Tryptophane contenu dans ZENITYL
Please sign in first.
Se connecter